Portale "Ingegneria e Campanologia" - Autore - Sommario - Mappa del Sito - Home
Usura dei materiali, dei metalli e
fessurazioni
AREA I - ARTE TECNICO-SCIENTIFICA (ATS)
Cap. ATS-O01 - Degrado dei materiali e dei metalli - Pag. ATS-O01.02
Gli argomenti trattati sono stati inseriti da Ing. Arch. Michele Cuzzoni nel 2012 - © Copyright 2007- 2025- e sono desunti dalla documentazione indicata in Bibliografia a fondo pagina
Natura della Corrosione - Protezione Materiali e Leghe
La corrosione semplice può essere in genere descritta tramite una reazione eterogenea di tipo chimico o elettrochimico, che avviene sulla superficie di un metallo o di una lega; il metallo in questa reazione viene ossidato, intendendo in senso più ampio ogni reazione in cui il metallo stesso perde degli elettroni [1].
Molti metalli e molte leghe tendono spontaneamente ad ossidarsi per la loro instabilità dovuta a fattori termodinamici, i quali sono anche i parametri da cui dipende la velocità di ossidazione iniziale.
Successivamente la nuova fase che viene a formarsi e che è in contatto con l'ambiente aggressivo può modificare l'andamento della velocità e della natura della corrosione. Il più comune tra i prodotti di corrosione è la ruggine che si ottiene sulle leghe del ferro a seguito di un'ossidazione in atmosfera.
|
REAZIONE |
VARIAZIONE NELL' ENTALPIA LIBERA PER 1 MOLE DI METALLO (Kj) |
|
|
CON EVOLUZIONE DI IDROGENO pH=0 |
CON DEPOLARIZZAZIONE DA OSSIGENO pH=0 |
|
|
Au® Au+++ |
+434 |
+319 |
|
Pd® Pd++ |
+196 |
+113.5 |
|
Ag® Ag++ |
+77.3 |
+36.8 |
|
Cu® Cu++ |
+65.2 |
-12.2 |
|
H® H+ |
0 |
-18.8 |
|
Pb® Pb++ |
-24.7 |
-101.8 |
|
Sn® Sn++ |
-26.6 |
-103.9 |
|
Ni® Ni++ |
-48.3 |
-125.7 |
|
Cd® Cd++ |
-77.9 |
-135.8 |
|
Fe® Fe++ |
-85.0 |
-162.3 |
|
Cr® Cr+++ |
-214.3 |
-332 |
|
Zn® Zn++ |
-147.5 |
-226 |
|
Mn® Mn++ |
-228 |
-305 |
|
Al® Al+++ |
-481 |
-597 |
|
Mg® Mg++ |
-457 |
-518 |
Tabella 01. Variazione dell'entalpia libera nel passaggio dal metallo allo stato ossidato [1]
Altri metalli che danno prodotti di corrosione che si ottengono con una certa probabilità si possono dedurre dalla tabella 01 e sono ad esempio magnesio, alluminio, manganese, zinco, cromo, ecc.
Sperimentalmente si osserva come molti di questi metalli (Al, Cr, Ti Zr, ecc.) presentino comunque una resistenza ai diversi ambienti aggressivi apprezzabilmente superiore a quella del ferro. Questo fatto è imputabile proprio alle nuove fasi che si sono formate, queste fasi sono generalmente dei film molto sottili di prodotti di corrosione; tale fenomeno è molto più apprezzabile ad esempio su cromo e alluminio che non sul ferro. Questo spiega il diverso comportamento delle leghe rispetto alla posizione nella serie normale del potenziale d'elettrodo dei metalli. Un raffronto tra questi due diversi comportamenti è evidenziato nella tabella 02.
| NOBILTA' ELETTROCHIMICA | RESISTENZA ALLA CORROSIONE | ||||
| +1.5 | Au |
Au |
® Grafite | ||
| +1.2 | Pt |
Pt |
|||
| +0.987 | Pd |
Pd |
|||
| +0.799 | Ag |
Zr |
® |
Hastelloy C Cr18Ni9Mo Incoloy 800 Cr18Ni9 Inconel 600 Acciai al Cr |
PASSIVI |
| +0.337 | Cu |
Ti |
|||
| -0.126 | Pb |
Ag |
|||
| -0.136 | Sn |
Mo |
|||
| -0.20 | Mo |
Cr |
|||
| ® |
Hastelloy B Inconel 600 Hastelloy C |
ATTIVI | |||
| -0.25 | Ni |
Cu |
|||
| -0.403 | Cd |
Ni |
|||
| ® |
Cr18Ni9Mo Incoloy 800 Niresist Acciai al Cr |
||||
| -0.440 | Fe |
Pb |
|||
| -0.740 | Cr |
Al |
|||
| -0.763 | Zn |
Sn |
® Acciai comuni | ||
| -1.18 | Mn |
Fe |
|||
| -1.53 | Zr |
Cd |
|||
| -1.63 | Ti |
Zn |
® Leghe del Mg | ||
| -1.66 | Al |
Mg |
|||
| -2.37 | Mg |
Mn |
|||
Tabella 02 Comparazione della nobiltà elettrochimica con la resistenza effettiva alla corrosione di alcuni metalli e alcune leghe
(ci si riferisce al potenziale d'elettrodo a 25° e ai potenziali di depolarizzazione) [1]
Il comportamento dei metalli può essere descritto andando ad individuare le zone in cui il metallo ha diversa stabilità elettrochimica ossia zone in cui si comporta in maniera diversa verso l'ambiente aggressivo.
Questo tipo di lavoro è stato eseguito molto approfonditamente per molti metalli in acqua da Pourbaix [2], il quale mettendo su un diagramma in ascisse il pH e in ordinate il potenziale di ossidazione determinò per molti metalli le rispettive aree di stabilità termodinamica (passività, immunità, formazione di particolari prodotti, ecc.).
Per le leghe è difficile valutare l'effetto dei diversi leganti anche se è possibile avere qualche dato indicativo, inoltre gli ambienti in cui queste andranno a lavorare sono molto variabili perciò i diagrammi così ottenuti non sono molto utili e ci si basa quindi su prove sperimentali appositamente ideate. Da queste prove si ottengono le curve di polarizzazione che mettono in relazione la densità di corrente in scala logaritmica con il potenziale di ossidazione e permettono di individuare le diverse zone di comportamento di un determinato materiale considerato e di studiarne la protezione adeguata.
|
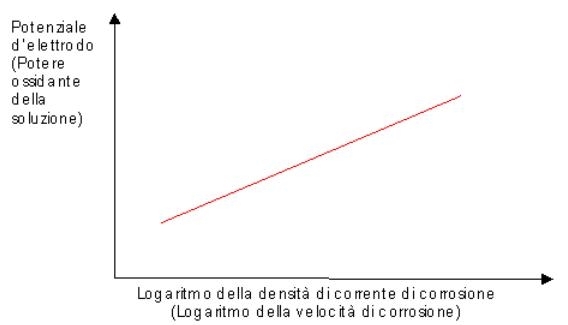
Figura 01 Curva di polarizzazione generica per una lega o un metallo "normale" (che non presenta passivazione) [4] |
La forma e la posizione delle curve di polarizzazione è regolata dalla composizione e dalla temperatura della soluzione, e dalla composizione chimica e dalla struttura del metallo o della lega che si sta considerando. Questo approccio può essere utilizzato nello studio della corrosione di moltissimi metalli e leghe, è infatti possibile andare ad individuare dall’andamento della curva il comportamento del materiale e paragonarlo ad altri. Nel caso in cui si abbia a che fare con metalli che si possono indicare come "normali" la curva assume l’andamento mostrato in figura 01 a sinistra. Si osserva che la velocità di corrosione aumenta con andamento logaritmico all’aumentare del potere ossidante della soluzione [4,11]. |
|
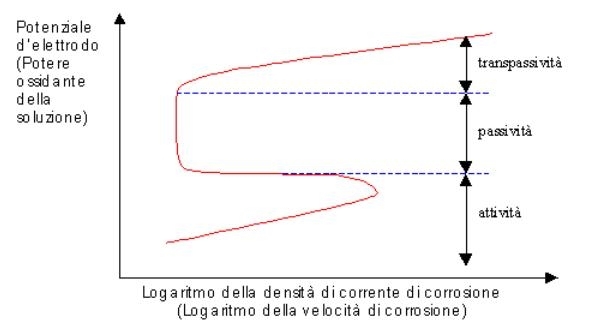
Figura 02 Curva di polarizzazione generica per una lega o un metallo che presenta passivazione [11] |
Per una generica lega passivabile invece in generale si trovano tre regioni fondamentali [4,11] come è osservabile dalla figura 02: |
-
Zona d'attività. In questa regione il materiale si comporta come se fosse "normale" (stesso andamento che presentano i metalli non passivabili) a seconda del potenziale a cui ci si trova si osservano fenomeni quali:
-
evoluzione d'idrogeno,
-
immunità;
-
corrosione.
In genere lo sviluppo di idrogeno si ha mentre l’acciaio è in fase attiva di dissoluzione. Se la regione di immunità è sufficientemente estesa allora la reazione di depolarizzazione (riduzione ed evoluzione d'idrogeno) si ottiene solo per potenziali considerevolmente negativi, cioè quando la dissoluzione anodica è molto piccola. In questo caso il materiale è molto resistente già nello stato attivo. Se invece la regione di immunità è piccola o del tutto assente nella curva, la lega risulta non resistere molto bene nello stato attivo.
La regione di immunità è più estesa per i materiali elettrochimicamente più nobili e per i metalli aventi una più elevata sovratensione d'idrogeno. Si possono usare questi metalli anche come leganti per migliorare la resistenza dell'acciaio nello stato attivo.
-
Zona di passività. A potenziali superiori la velocità di corrosione (proporzionale alla densità di corrente) mostra un decremento: la lega o il metallo preso in considerazione è passivato, cioè risulta coperto da un film d'ossido che può proteggerlo dal proseguimento dell'azione corrosiva. Il potenziale di passivazione è variabile a seconda della composizione del materiale, per esempio aggiunte di Cr in lega col Fe modificano il potenziale di passivazione portandolo a valori più bassi fino anche a renderlo negativo come si può osservare in tabella 03:
EP[mV]
Fe puro
+580
Fe-Cr 2.2%
+670
Fe-Cr 4.4%
+660
Fe-Cr 7.5%
+590
Fe-Cr 9.2%
+500
Fe-Cr 9.8%
+300
Fe-Cr 11.6%
+280
Fe-Cr 14.2%
+70
Fe-Cr 19.1%
-20
Fe-Cr 24.4%
-80
Fe-Cr 30.4%
-90
Fe-Cr 34.9%
-120
Cr puro
-220 / -250
Tabella 03. Potenziali di passivazione di leghe Fe-Cr a pH=0 e 20°C [4]
Purtroppo valori negativi del potenziale di passivazione non sono sempre sufficienti per ottenere autopassivazione dell'acciaio, come ad esempio nel caso di soluzioni acide. Infatti la seconda condizione necessaria per avere una lega autopassivante è che la specie che si riduce possa produrre una sufficiente densità di corrente durante la sua riduzione; questo si ha con un potenziale più positivo del potenziale di passivazione.
Per avere una protezione migliore si vuole che la regione di passività sia la più estesa possibile: in questa zona, infatti, la velocità di corrosione rimane pressoché costante.
-
Zona di transpassività. Questa zona si presenta a potenziali estremamente elevati (alta concentrazione dell’ossidante o potere ossidante molto forte). Si osserva che in tale regione la velocità di corrosione ricomincia a crescere col crescere del potenziale d’elettrodo. Si possono quindi osservare fenomeni quali:
-
corrosione del metallo,
-
passivazione secondaria aumentando il potere ossidante,
-
evoluzione di ossigeno a potenziali particolarmente elevati.
Questi acciai sono studiati per resistere agli agenti corrosivi riducendo in questo modo sia problemi estetici che meccanici.
In questi acciai la resistenza alla corrosione è data dalla presenza tra i leganti del Cr il quale agisce formando sulla superficie uno strato di ossido. Lo strato che si forma è molto sottile (qualche decina di micron), compatto e aderente: in pratica il cromo si ossida facilmente ed evita così il contatto diretto dell'ambiente con il ferro che costituisce l'acciaio.
Questo strato si riesce ad ottenere se la percentuale di Cr presente in lega è superiore al 12%, altrimenti l'ossido che si ottiene risulta poco compatto e perciò poco protettivo. Questo tipo di protezione risulta in genere ottimale nelle più svariate condizioni, dall'ambiente umido, all'ambiente marino, alle alte temperature ecc. Il meccanismo di formazione dell'ossido è però diverso a seconda dell'ambiente in cui ci si trova.
Esistono diversi tipi di acciai inox, ma si possono comunque distinguere alcune classi principali [6]:
FERRITICI
MARTENSITICI
AUSTENITICI
DUPLEX
INDURITI PER PRECIPITAZIONE
Storicamente i primi tre gruppi sono stati i primi ad essere scoperti ed utilizzati, tra questi la miglior resistenza all'ossidazione ce l'hanno mediamente gli austenitici mentre le migliori proprietà meccaniche sono dei martensitici.
Gli acciai duplex sono invece stati scoperti in seguito quasi per caso cercando di valutare il comportamento di alcuni acciai ferritici che per errore di processo contenevano anche una certa percentuale di austenite. Si è così scoperto la loro validità e li si è incominciati ad utilizzare.
Successivamente sono nati i super-duplex che contengono anche N e che presentano una elevata resistenza alla stress corrosion; questi acciai risultano quindi particolarmente adatti per le strutture off-shore.
Gli acciai inox induriti per precipitazione presentano una buona resistenza meccanica e possono essere impiegati alle elevate temperature. Di seguito sono analizzate le singole classi di acciai inox separatamente [6,13]:
In questa classe di acciai si trovano acciai che contengono essenzialmente Cr e C (in percentuale in genere inferiore allo 0.1%, ma che può crescere se aumenta la quantità di Cr presente), che vengono induriti per lavorazione a freddo.
|
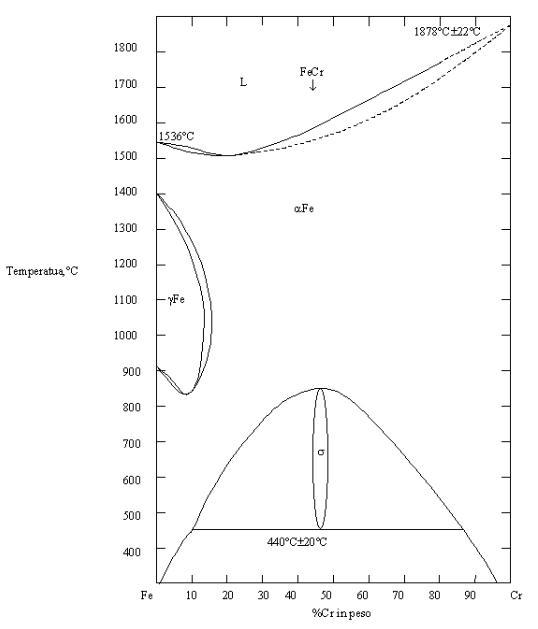
Figura 03. Diagramma di fase Fe-Cr [5] |
Considerando il diagramma di equilibrio Fe-Cr di figura 03 a sinistra, si osserva l’azione a-gena del Cr. Con una percentuale di Cr tra il 42% e il 48% si ha una fase s, che è "cattiva" perché è un composto intermetallico con il 45% in Cr. Per chi produce inox questo composto è molto pericoloso perché si può formare localmente e portare ad impoverimento di Cr in altre zone dove si potrebbe quindi ottenere corrosione localizzata. Questa fase è favorita sotto gli 820°C, ma a temperatura ambiente manca la diffusione perciò è pericolosa soprattutto nelle saldature. Con la presenza del C le cose si modificano, infatti il C è un g-geno per cui serve ancora più Cr per poter "chiudere" la fase g. Se si vogliono acciai ferritici si deve quindi cercare di avere una percentuale di C bassa e una percentuale di Cr di circa il 13%. In questa classe si trovano anche gli acciai a lavorabilità migliorata (contengono S e Se), adatti a lavorazioni per asportazione di truciolo, ma con proprietà meccaniche non eccelse. Possono essere aggiunti anche Mo (resistenza in ambiente salino ad esempio acqua di mare) oppure Nb e Ta (per migliorare la resistenza meccanica alle alte temperature). Le caratteristiche generali di questo tipo di acciai sono una buona resistenza a corrosione, non elevate proprietà meccaniche e la presenza di proprietà magnetiche. Un tipico acciaio appartenente a questa classe è l'AISI 430 che occupa l'80% del mercato. Esistono poi in questa classe gli acciai E.L.I. (extremly low interstitial) che hanno un basso tenore di C e contengono S (interstiziale). Questi acciai presentano una maggior duttilità e un'inossidabilità vicina agli austenitici. |
|
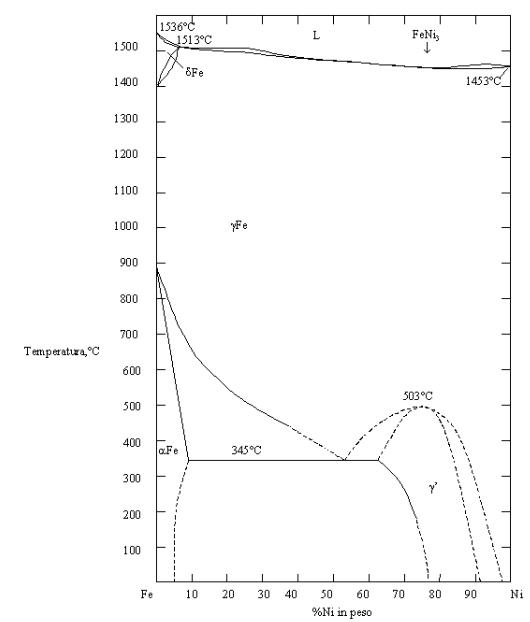
Figura 04. Diagramma di fase Fe-Ni [5] |
Questi acciai oltre a Cr e C (0.1%-0.4%) contengono Si e Ni e naturalmente si ottengono esclusivamente tramite un trattamento termico adeguato (tempra seguita da bonifica). La tempra non influisce sull'inossidabilità data dal Cr mentre il rinvenimento successivo, modificando la microstruttura agisce in tal senso. Qualitativamente si può osservare in un rinvenimento completo si ottiene una microstruttura del tipo: a +Fe3C/(Fe,Cr)C che presenta una durezza inferiore e una duttilità maggiore rispetto ad una struttura del tipo: a '+carburi e (Fe,Cr) Quest'ultima struttura presenta una resistenza a corrosione migliore perciò per usi in cui questa è particolarmente importante (pompe per liquidi fisiologici) non si va a rinvenimento completo.
|
Per poter avere dell'austenite è necessario che venga aggiunto un g-geno, perciò questi acciai contengono oltre a Cr e C (<<0.1%) anche del Ni. In questi acciai vengono anche spesso aggiunti Ti (per ridurre il problema della sensibilità), N (per indurire) e S (per migliorare la lavorabilità all'utensile).
Questo tipo di inox presenta una lavorabilità superiore a martensitici e ferritici ed anche una migliore resistenza alla corrosione. Oggi ci sono anche acciai Ni-free cioè acciai in cui il Ni, che crea allergie, viene sostituito dal Mn (anch'esso g-geno).
Tra gli acciai inox austenitici è molto diffuso l'AISI 304 (18%Cr-8%Ni) che ha una buonissima resistenza alla corrosione (es.: botti vino rosso), in ambienti con un acidità maggiore si usa invece l'AISI 316 (es.: botti vino bianco).
Sul diagramma Fe-Ni di figura 04, si osserva che il Ni provoca una crescita della zona in cui si ha fase g . Sarebbe opportuno in realtà studiare un diagramma quaternario Fe-Ni-Cr-C per poter studiare l'effetto combinato dei diversi leganti.
|
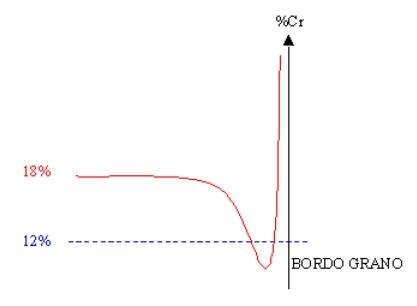
Figura 05. Effetto della sensibilizzazione [7] |
Come si è detto un grosso problema di questo tipo di acciai in particolare è la sensibilizzazione [7] che porta a una successiva corrosione a bordo grano: ciò che accade è che a seguito di qualche lavorazione si ha la precipitazione di carburi di cromo a bordo grano (dove si ha un D G più elevato), perciò la percentuale di cromo diviene particolarmente elevata a bordo grano e scende drasticamente in prossimità di questo a seguito dell'impoverimento subito per la formazione dei carburi. Perciò vicino al bordo il tenore di cromo può anche scendere sotto il 12% non garantendo più un ottimale protezione e portando eventualmente a corrosione localizzata, figura 05 a sinistra. Questo tipo di attacco è molto nocivo perché "rompe" l'unione tra i grani, e se il grano viene completamente "circondato" salta via portando ad un intaglio sulla superficie. |
Questo fenomeno per gli inox è il peggiore, infatti la corrosione localizzata al contrario di quella omogenea non è controllabile e gestibile. La precipitazione è favorita in particolare tra i 500°C e i 900°C e quindi la si ottiene durante processi come le saldature ad esempio. Per evitare questo problema si può agire in tre modi:
Utilizzare acciai con percentuali di C inferiori allo 0.02% (inox L), così il fenomeno diminuisce. Questo è ciò che si fa più spesso.
In passato si introducevano elementi con una maggiore elettroaffinità al C rispetto al Cr, in tal modo si formano carburi con questi elementi e non col Cr; elementi di questo tipo sono Ti e Nb.
Si può agire dopo la saldatura risolubilizzando i carburi, portando il pezzo a temperature elevate e raffreddandolo velocemente. Questo procedimento risulta però essere unicamente un rimedio e bisogna porre molta attenzione alla distensione.
Un altro problema che questi acciai presentano è la stress corrosion ma se si conoscono i carichi agenti questo fenomeno è abbastanza prevedibile.
Gli inox austenitici resistono inoltre meglio alle basse temperature rispetto a martensitici e ferritici in quanto presentano in genere una temperatura di transizione duttile fragile molto più bassa.
Sono acciai che hanno una microstruttura costituita da due fasi, ferritica ed austenitica (approssimativamente in egual proporzione); tale microstruttura è data dai diversi leganti presenti che sono Cr, Ni, Mn, Mo, Cu, N, S. Paragonati agli inox classici presentano resistenze a corrosione migliore rispetto agli austenitici e proprietà meccaniche intermedie tra ferritici e martensitici e quindi molto buone.
Un vantaggio di questo tipo di acciai è infatti che la presenza della ferrite porta ad un miglioramento della resistenza ad allungamento rispetto agli austenitici.
Un ulteriore vantaggio è che la presenza della ferrite porta ad un affinamento della grana austenitica, il che porta ad un ulteriore miglioramento nella resistenza. Questi due effetti combinati ad un adatto processo termico di invecchiamento tra 900°C e 1050°C, che produce un ulteriore rifinitura nelle dimensioni della grana e porta ad avere una dispersione molto fine di ferrite ed austenite, portano all'elevato sforzo a rottura che viene raggiunto (circa 400 MPa che è quasi il doppio rispetto agli austenitici classici).
La struttura bifasica è vantaggiosa anche perché migliora notevolmente la resistenza alla corrosione sotto sforzo (stress corrosion cracking) e a molti fenomeni legati alla corrosione intergranulare, infatti le particelle ferritiche impediscono la propagazione delle cricche che si formano nei grani austenitici o ai bordi di questi grani. Questi acciai sono invece soggetti a knife line attack specialmente in presenza di acido nitrico [10].
|
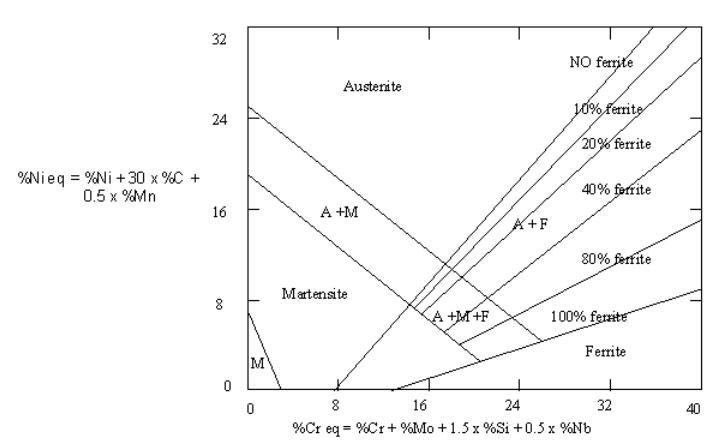
Figura 06. Diagramma di Shaeffler [9] |
Per ottenere la giusta combinazione di fase a e fase g si devono dosare bene le quantità necessarie di a-geni e g-geni utilizzando diagrammi come quello di Shaeffler, figura 06 a sinistra. Per utilizzare questo diagramma si trasformano le quantità di a -geni in Cr-equivalenti e di g -geni in Ni-equivalenti e con questi dati si riesce a determinare la composizione finale di ferrite, austenite e martensite. Questo tipo di acciai non può venire impiegato se le temperature di lavoro superano i 300°C perché la stabilità di questa struttura è bassa in queste condizioni. L'azoto porta ad un miglioramento delle proprietà sia meccaniche che anticorrosive, ma N è un g -geno perciò se ne deve tener conto. Gli acciai duplex contenenti azoto vengono chiamati superduplex. |
In genere contengono Cr, Ni, C, Al, Mo, Cu. Questi acciai possono essere martensitici, semiaustenitici oppure austenitici. I primi rimangono martensitici anche dopo la precipitazione, i secondi possono presentare struttura martensitica dopo trattamento termico, gli ultimi rimangono invece austenitici anche dopo la precipitazione (che deve essere effettuata a temperature maggiori).
Questi acciai sono meno diffusi nell’uso ingegneristico rispetto agli acciai inox classici (austenitici, ferritici, martensitici), infatti sono impiegati quasi esclusivamente in settori speciali quali aeronautica, aereospazio, missilistica, ecc..
Tra i metalli e le leghe di interesse industriale ve ne sono diverse che presentano particolari caratteristiche di resistenza alla corrosione: leghe dell’Al, leghe del Ti, leghe del Ni, ecc.
Esistono inoltre numerose possibilità di rivestire diverse leghe in modo da proteggerle dall’ossidazione: cromatura, doratura, zincatura, ecc.. In questo paragrafo verrà descritto il comportamento verso la corrosione di alcuni dei più importanti metalli commerciali e delle loro leghe [14,15].
L’alluminio è un metallo che già in un condizioni scarsamente ossidanti produce velocemente un ossido, che viene chiamata allumina (Al2O3), molto resistente e compatto e quindi passivante.
Tra le leghe di questo metallo quelle che presentano caratteristiche meccaniche più elevate sono in generale quelle della serie 7000 (nomenclatura australiana, vedi tabella 04), che contengono zinco. Questa categoria di leghe non ha però ottimali caratteristiche di resistenza a corrosione perciò spesso si preferisce usare leghe della serie 2000 (con rame) alle quali vengono aggiunti altri elementi quali Cr, Mn, Zr per ridurre il fenomeno della stress corrosion (un problema delle leghe dell’Al con il Cu).
|
SERIE |
ALTRI LEGANTI CONTENUTI NELLA LEGA |
|
1XXX |
99,00% di Al minimo |
|
2XXX |
Cu |
|
3XXX |
Mn |
|
4XXX |
Si |
|
5XXX |
Mg |
|
6XXX |
Si e Mg |
|
7XXX |
Zn |
|
8XXX |
Altri |
Tabella 04. Classificazione delle leghe di Al secondo la nomenclatura australiana
Le leghe della serie 6000 non presentano caratteristiche meccaniche ottimali perciò in alcune leghe appartenenti a questa serie (6151, 6061, 6063) viene aggiunto del Cu che permette il miglioramento delle proprietà meccaniche. In queste leghe si deve aggiungere anche del Cr che contrasta l’effetto negativo sulla resistenza a corrosione dato dal Cu.
Nelle leghe della serie 5000 il tenore di Mg può superare il 3% in tal caso c’è pericolo di ottenere corrosione intergranulare a seguito della precipitazione a bordo grano di fase b (Mg5Al8).
L’Al e le sue leghe sono sempre rivestiti da uno strato di ossido grazie all’elettronegatività dell’Al, ma tale strato risulta essere ottimale se il suo sviluppo viene indotto sul pezzo in produzione tramite un processo chiamato anodizzazione. Questo trattamento consiste nel produrre lo strato di ossido mediante passaggio di corrente, in questo modo si ottiene una microstruttura dell’ossido ideale per garantire un'ottimale protezione.
Il titanio presenta anch’esso come l’alluminio uno strato di ossido molto protettivo, la titania (TiO2), inoltre le sue leghe hanno una resistenza meccanica specifica molto elevata; è per questi motivi che questo metallo è molto interessante in settori dell’industria quali l’aeronautica e la missilistica dove c’è bisogno di avere materiali leggeri che siano adatti anche ad ambienti abbastanza aggressivi, ma anche in settori classici come l’industria chimica. La sua resistenza a corrosione è molto elevata infatti si comporta molto bene sia in acqua marina (a 25°C e areata, la resistenza è vicina a quella del Pt) sia in soluzione di NaCl al 6%. La resistenza di queste leghe è ottimale anche in presenza di ipocloriti o di acido nitrico fumante. Non è invece un materiale adatto all’utilizzo ad alte temperature.
E’ difficile generalizzare le proprietà delle leghe del Ti comunque si possono fare alcune considerazioni sull’azione dei diversi leganti verso la resistenza a corrosione.
Il Ti in lega con l’Al presenta il problema della stress corrosion causata dalla precipitazione di Ti3Al. Essendo la lega Ti-6Al-4V la lega del Ti più diffusa perché combina ottime proprietà meccaniche a una buona resistenza a corrosione questo problema è molto importante e deve essere evitato tramite un trattamento termico di precipitazione adeguato.
Il Cr può essere alligato al Ti per migliorare ulteriormente la resistenza a corrosione, ma in tal modo si abbassa di molto la temperatura di inizio della trasformazione martensitica (Ms) e questo rende la tempra molto più difficile, perciò si deve in questo caso aggiungere anche Mo o V (in questo modo si riesce a temprare la lega e si possono così avere proprietà meccaniche ottimali). Si usano quindi ad esempio leghe con un contenuto del 11% in Cr e del 13% in V, anche se oggi è possibile eseguire delle tempre criogeniche, con dei costi però elevati.
In lega con un 30% di Mo la resistenza all’acido cloridrico risulta notevolmente migliorata. Piccole aggiunte di Pt, Pd e altri metalli nobili migliorano di molto la resistenza alla corrosione, esistono quindi in commercio leghe che contengono una tenore di Pd di 0.15%, ma il loro uso è limitato dai costi elevati. Una resistenza a corrosione paragonabile a quella fornita dai metalli nobili in lega è ottenibile con un contenuto di Mo dello 0.3% e di Ni dello 0.8% (NiCode 12).
Un importante gruppo di materiali per applicazione nel campo della corrosione è basato sul Ni.
Il Ni è resistente all’azione di molti ambienti corrosivi e vista la sua elevata resistenza agli ambienti alcalini lo si utilizza per risolvere molti problemi dovuti a soluzioni caustiche. Infatti la resistenza di una lega in idrossido di sodio è direttamente proporzionale al contenuto di Ni. Per esempio si può osservare la resistenza nettamente superiore di un acciaio che contiene il 2% di Ni rispetto ad un acciaio non legato. Il Ni inoltre migliora notevolmente (anche del 10%) la resistenza a stress corrosion nelle leghe inossidabili. Il Ni presenta un'ottima resistenza anche in soluzioni neutre o leggermente acide perciò il suo utilizzo è molto diffuso nell’industria alimentare. Non resiste molto bene invece in ambienti fortemente ossidanti come acido nitrico e soluzioni ammoniacali. Le leghe del Ni hanno proprietà meccaniche elevate anche alle alte temperature ma in tali condizioni sono facilmente infragilite da attacchi di gas solforici.
Le leghe in commercio possono avere un tenore di Ni molto variabile perciò presentano proprietà meccaniche molto variabili.
La lega Duranichel invecchiata presenta ottime proprietà meccaniche e un altrettanto ottima resistenza ai diversi ambienti.
La lega Monel è adatta a resistere ad attacchi dell’acido fluoridrico.
Le leghe chlorimet e hastelloy C sono le più comuni leghe in commercio per la resistenza a corrosione.
Il rame è diverso dalla maggior parte degli altri metalli infatti esso combina resistenza a corrosione, alte conducibilità termiche ed elettriche, una buona lavorabilità e un ottima resistenza meccanica (eccetto alle alte temperature) se è in lega. Il Cu ha una resistenza ottimale in atmosfere e acque urbane, marine e industriali.
Il Cu è un metallo nobile e l’evoluzione d’idrogeno non fa parte del processo corrosivo; per questa ragione non viene corroso se non ci sono ossigeno o altri agenti ossidanti (es: HNO3) presenti. Per esempio la reazione tra Cu e acido solforico non è termodinamicamente possibile, ma la corrosione procede in presenza di ossigeno e i prodotti di reazione sono solfato di rame e acqua.
Il rame e le sue leghe sono resistenti a soluzioni neutre o leggermente alcaline con eccezione di quelle contenenti ammoniaca che causa stress corrosion e qualche volta un rapido attacco generalizzato.
Le leghe del rame più comuni sono ottoni (Cu+Zn), bronzi (Cu+Sn,Al o Si) e cupronichel (Cu+Ni).
La lega Nichel silver non contiene in realtà Ag ma ne imita l’aspetto; questa lega è spesso la base con cui si ottiene il silver-plate.
La lega Everdur possiede una resistenza meccanica relativamente elevata e perciò viene usata per viti e bulloni in apparecchi costruiti interamente in rame, al fine di minimizzare la corrosione bimetallica.
Il Cu e gli ottoni sono soggetti a corrosione-erosione, i bronzi e gli ottoni all’Al da questo punto di vista sono migliori. Le leghe cupronichel addizionate con un po’ di Fe sono ancora superiori nella resistenza a questo fenomeno.
Il Mg è uno dei metalli più leggeri in commercio (peso specifico 1.74); viene utilizzato in campo automobilistico, aeronautico, missilistico e in molti altri campi per il suo basso peso e le sue buone prestazioni meccaniche quando è in lega. Purtroppo è uno dei metalli meno resistenti alla corrosione ed infatti è usato come elettrodo sacrificale per la protezione anodica, perché è generalmente anodico rispetto agli altri metalli o leghe.
Il magnesio presenta una buona resistenza alle atmosfere ordinarie dovuta alla formazione di un film protettivo di ossido. Questa protezione tende a rompersi in aria contaminata da sali e sono quindi richieste misure protettive, come rivestimenti. Generalmente la resistenza a corrosione diminuisce con la presenza in lega di impurità o altri leganti.
Le leghe sono soggette anche a stress corrosion e vanno quindi protette da questo fenomeno. Il metallo è invece suscettibile di corrosione-erosione. Il Mg è più resistente dell’alluminio verso gli alcali; è invece attaccabile da molti acidi eccetto l’acido cromico e fluoridrico (i prodotti della corrosione in HF agiscono da film protettivo).
Portale "Ingegneria e
Campanologia" -
Autore -
Sommario
- Mappa del Sito -
Home
Bib-TS-000 - Testo di Ing. Arch. Michele Cuzzoni
Bib-TS-290 - V. Cihal, Intergranular corrosion of steels and alloys, - 1984, Elsevier, Londra e New York; pp 4-7, 20-23, 43-62, 62-63, 218-227
Bib-TS-291 - M.Pourbaix, Atlas d'Equilibres Electrochimiques à 25°C, - 1963, Gauthier-Villars, Parigi.
Bib-TS-292 - M.G.Fontana, Corrosion engineering - McGraw-Hill Book Company, pp 21-22, 39-152, 225-236, 236-259
Bib-TS-293 - P. Marshall, Austenitic stainless steels - Elsevier Applied Science Publisher, Londra e New York; pp 1-20, 69, 377-383
Bib-TS-294 - G.W.Stachowiach A.W.Batchelor, - Engineering tribology, - Elsevier Applied Science Publisher, Londra e New York; pp 2-6., 557-562, 574-580, 586-591, 597-600, 603-605, 605-607, 613-616, 652-653, 657-672, 684-685, 637-645, 645-654
Bib-TS-295 - G.W.Stachowiach A.W.Batchelor, - Materials for tribology, Elsevier Applied Science Publisher, Londra e New York; pp 8-9, 46-47, 69-72, 114-116.
Bib-TS-296 - G.W.Stachowiach A.W.Batchelor - Predicting sinergism between corrosion and abrasive wear, WEAR, 1988; vol. 123, pp 281-291
Bib-TS-297 - H.G.Zenders - La corrosion superficielle dans le circuit de lavage des charbonnages des mines de l’etat neerlandais - 1949, Metaux et Corrosion; vol. 65, pp 25-76
Bib-TS-298 - A.T.Fromhold - Theory of metal oxidation, Fundamentals - 1976, Elsevier, Amsterdam; vol.1
Bib-TS-299 - G.W.Stachowiach A.W.Batchelor A.Cameron - The relationship between oxide films and the wear of steels - Wear, 1986; vol. 113, pp 203-223
Bib-TS-300 - N.S.Isaaca - Liquid phase high pressure chemistry - 1981, John Wiley, New York, pp 181-351
Bib-TS-301 - W.Nicodemi - Introduzione agli acciai inossidabili - Aim, 1996, p 130
Bib-TS-302 - A.Hedayat S.Yannacopoulos J.Postlethwaite - Wear and corrosion of steel couplings and tubing in heavy oil screw-pump wells - Wear, 1997; vol. 209, pp 263-273
Bib-TS-303 - K.C.Barker A.Ball - Synergistic abrasive-corrosive wear of chromium containing steels - Br. Corrosion J., 1989; vol. 24, p 222
Bib-TS-304 - R.Jasinski - Corrosion of N80-type steel by CO2/water mixtures - Corrosion, 1987; vol. 47, p 214
Bib-TS-305 - X.C.LU S.Z.LI X.X.Jiang T.C.Zhang - Effect of g phase on corrosive wear of duplex stainless steel in sulfuric acid solution - Corrosion, 1995; vol. 51, pp 456-452